Phương trình chất hóa học - Những điều bạn phải biết
Hóa học là 1 cỗ môn không xa lạ với chúng ta học viên kể từ cấp cho Trung học tập hạ tầng trở lên trên. Và Hóa học tập cũng là 1 cỗ môn “gây thù oán chuốc oán” tối đa với chúng ta học viên. Đây cũng chính là môn học tập chiếm hữu những tấm hình chế “có 1 - 0 - 2” bá đạo nhất.
Bạn đang xem: Phương trình hóa học đầy đủ chi tiết nhất
1. Phương trình chất hóa học là gì?
Phương trình chất hóa học là phương trình trình diễn cộc gọn gàng phản xạ chất hóa học.
(Phản ứng chất hóa học là quy trình làm cho thay đổi từ 1 tập trung hóa chất này trở nên một tập trung hóa chất không giống, phản xạ chất hóa học xẩy ra khi sở hữu những ĐK mến hợp).
Trong phương trình chất hóa học, những hóa học sẽ tiến hành trình diễn bên dưới dạng kí hiệu chất hóa học của hóa học cơ. Chất ở phía bên trái mũi thương hiệu là hóa học nhập cuộc và hóa học ở bên phải mũi thương hiệu là hóa học thành phầm.
Ví dụ: Hidro + Oxi -> Nước
\(H_2 + O_2 \rightarrow H_2O\)
Chất tham ô gia: \(H_2; O_2\)
Chất sản phẩm: \(H_2O\)
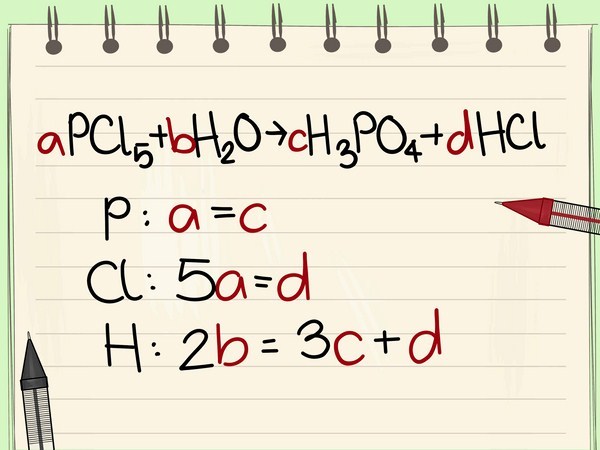
Cân vì chưng phương trình hóa học
2. Ý nghĩa phương trình hóa học
-
Biểu biểu diễn cộc gọn gàng những phản xạ hóa học
-
Cho tao biết tỉ lệ thành phần về số nguyên vẹn tử, số phân tử trong những hóa học và trong những cặp hóa học vô phản xạ chất hóa học. Tỉ lệ này vì chưng tỉ lệ thành phần thông số trong những hóa học vô phương trình chất hóa học.
3. Các bước lập phương trình hóa học
Để lập phương trình chất hóa học, chúng ta cần thiết thực hiện theo thứ tự 3 bước sau:
-
Bước 1: Viết sơ vật dụng phản xạ (gồm kí hiệu chất hóa học của những hóa học nhập cuộc và những hóa học sản phẩm)
-
Bước 2: Cân thông qua số nguyên vẹn tử của từng nhân tố, dò thám số tương thích bịa đặt trước những công thức sao mang lại số nguyên vẹn tử những nhân tố ở hóa học nhập cuộc và hóa học thành phầm nên đều nhau.
-
Bước 3: Hoàn trở nên phương trình chất hóa học.
4. Cách thăng bằng phương trình chất hóa học
Cân vì chưng phương trình chất hóa học là việc thăng bằng về con số nhân tố của những hóa học vô nhị vế của một phản xạ chất hóa học.
4.1. Phương pháp nguyên vẹn tử nguyên vẹn tố
Đây là cách thức giản dị và đơn giản nhất.
Cân vì chưng Theo phong cách này, tao tiếp tục ghi chép những đơn hóa học khí bên dưới dạng nguyên vẹn tử riêng không liên quan gì đến nhau.
Ví dụ: Cân vì chưng phương trình hóa học: \(P_2 + O_5 \rightarrow P_2O_5\)
Để tạo ra trở nên 1 phân tử \(P_2O_5\), tao cần thiết 2 phân tử Phường và 5 phân tử O.
=> Ta được phương trình:
\(2P + \dfrac{5}{2} O_2 \rightarrow P_2O_5\)
Nhân những phân số với khuôn mẫu số cộng đồng nhỏ nhất (ở phương trình này là 2) tao sẽ tiến hành phương trình chất hóa học cuối cùng:
\(P + 5O_2 \rightarrow P_2O_5\)
4.2. Phương pháp hóa trị tác dụng
Hóa trị thuộc tính là số hóa trị của những group nguyên vẹn tử hoặc nguyên vẹn tử của những nhân tố sở hữu vô Phản ứng chất hóa học.
Các bước thăng bằng với cách thức này:
-
Bước 1: Xác toan hóa trị tác dụng
\(BaCl_2 + Fe_2(SO_4)_3 \rightarrow BaSO_4 + FeCl_3\)
Hóa trị thuộc tính theo thứ tự của phương trình bên trên kể từ trái ngược qua loa nên là:
I - II - III - I - I - I - III - II
-
Bước 2: Tìm bội số cộng đồng nhỏ nhất của những hóa trị tác dụng
Bội số cộng đồng nhỏ nhất của (I,II,III) là 6.
-
Bước 3: Lấy bội số cộng đồng nhỏ nhất phân tách cho những hóa trị tao sẽ tiến hành thông số sau:
6 : 1 = 6
6: 2 = 3
6: 3 =2
-
Bước 4: Thay vô phương trình phản ứng
4.3. Phương pháp chẵn - lẻ
Dựa vô nguyên vẹn tắc: Sau khi thăng bằng, số nguyên vẹn tử của nhân tố ở hóa học nhập cuộc nên thông qua số nguyên vẹn tử của nhân tố ở hóa học thành phầm. Vậy nên nếu như số nguyên vẹn tử của một nhân tố tại 1 vế là số chẵn, thì nó cũng tiếp tục nên là số chẵn ở vế sót lại. Nên nếu như số nguyên vẹn tử của nhân tố còn lẻ, thì nên nhân đôi
Thí dụ: \(FeS_2 + O_2 \rightarrow Fe_2O_3 + SO_2\)
-
Ở vế trái ngược, số nguyên vẹn tử \(O_2\) là chẵn
-
Ở vế nên, số nguyên vẹn tử \(O_2\) vô \(SO_2\) là chẵn, tuy nhiên số nguyên vẹn tử vô \(Fe_2O_3\) lại là lẻ. => Phải nhân song. Sau cơ, tao thăng bằng những thông số còn lại
\(2Fe_2O_3 \rightarrow 4FeS_2 \rightarrow 8SO_2 \rightarrow 11O_2\)
Phương trình được cân nặng bằng:
\(4FeS_2 + 11O_2 \rightarrow 2Fe_2O_3 + 8SO_2\)
4.4. Cân vì chưng phụ thuộc nhân tố cộng đồng nhất
Với cách thức này, tao tiếp tục lựa lựa chọn nhân tố xuất hiện ở nhiều hóa học nhất vô phản xạ.
Ví dụ: \(Cu + HNO_3 \rightarrow Cu(NO_3)_2 + NO + H_2O\)
Nhận thấy, oxi là nhân tố xuất hiện tối đa vô phương trình phản xạ.
-
Vế nên sở hữu 8 oxi, vế nên sở hữu 3 oxi.
-
BSCNN của 3 và 8 là 24
=> Ghi 8 vô trước HNO3. Ta có:
\(8HNO_3 \rightarrow 4H_2O \rightarrow 2NO\)
Phương trình chất hóa học sau khoản thời gian được cân nặng bằng:
\(3Cu + 8HNO_3 \rightarrow 3Cu(NO_3)_2 + 2NO + 4H_2O\)
4.5. Cân vì chưng theo đuổi cách thức đại số
-
Dựa theo đuổi nguyên vẹn tắc: Số nguyên vẹn tử của những nguyên vẹn tử ở hai vế nên đều nhau.
Các bước làm:
-
Bước 1: Điền những thông số a,b,c,d,e,... vô trước những hóa học vô phản xạ.
Xem thêm: Tải Zoom Desktop Client cho PC
Ví dụ: \(aFeS_2 +bO_2 \rightarrow cFe_2O_3 + dSO_2\)
-
Bước 2: Dùng toan luật bảo toàn lượng nhằm thăng bằng nhân tố và đưa đến 1 phương trình đại số.
Fe: a = 2c
S: 2a = d
O: 2b = 3c + 2d.
Giải hệ phương trình bao gồm 3 phương trình bên trên.
Chọn c = 1 => a = 2, d = 4 và b =11/2.
Nhân những thông số với 2, tao được phương trình cân nặng bằng:
\(4FeS_2 + 11O_2 \rightarrow 2Fe_2O_3 + 8SO_2\)
II. Các dụng cụ nhớ dùng lúc học môn Hóa học
1. Bảng tuần trả nhân tố chất hóa học (Nguyên tố hóa học)

Bảng tuần trả nhân tố hóa học
Bảng tuần trả nhân tố chất hóa học (gọi tắt là Bảng tuần hoàn) là 1 bảng sở hữu liệt kê lại những nhân tố chất hóa học, dựa trên số hiệu nguyên vẹn tử (chính là số proton vô phân tử nhân), thông số kỹ thuật e (electron) và những đặc thù chất hóa học của bọn chúng. Các nhân tố vô bảng được bố trí theo hướng tăng dần dần số hiệu nguyên vẹn tử.
Một bảng chi phí chuẩn chỉnh bao gồm những nhân tố chất hóa học được xếp trở nên 7 dòng sản phẩm và 18 cột, 2 dòng sản phẩm kép riêng không liên quan gì đến nhau ở bên dưới nằm trong bảng. Các mặt hàng vô bảng sẽ tiến hành gọi là chu kì, còn cột sẽ tiến hành gọi là group. Một số những nhân tố sẽ có được những tên thường gọi quánh biệt: Halogen, khí khan hiếm.
Tất cả những phiên phiên bản của bảng tuần trả chỉ bao hàm những nhân tố chất hóa học, ko bao hàm láo lếu thích hợp, thích hợp hóa học,...
Bảng tuần trả nhân tố chất hóa học không thiếu thốn và rõ rệt nhất.
2. Dãy sinh hoạt chất hóa học của kim loại
Dãy sinh hoạt chất hóa học của sắt kẽm kim loại là mặt hàng bao hàm những sắt kẽm kim loại được bố trí theo đuổi theo trật tự tùy thuộc vào năng lực nhập cuộc phản xạ chất hóa học với hóa học không giống (còn gọi là cường độ phản ứng) của những sắt kẽm kim loại.
Đặc trưng của dãy:
-
Mức chừng sinh hoạt chất hóa học của sắt kẽm kim loại tiếp tục hạn chế dần dần kể từ trái ngược lịch sự phải
Dãy sinh hoạt chất hóa học của sắt kẽm kim loại khi mới nhất học tập tiếp tục khiến cho chúng ta vô cùng khó khăn lưu giữ. Để rất có thể ghi lưu giữ thời gian nhanh mặt hàng này, những chúng ta cũng có thể tìm hiểu thêm mẹo bên dưới đây:
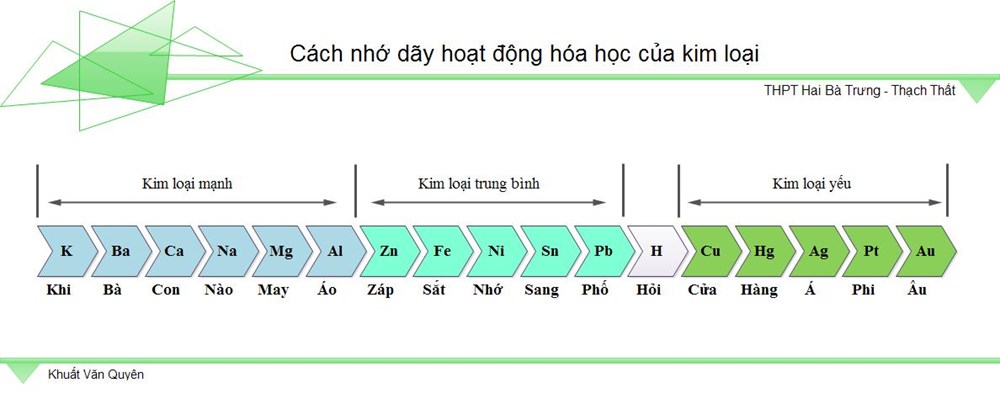
Mẹo lưu giữ Dãy sinh hoạt chất hóa học của kim loại
Hoặc Click vô liên kết sau nhằm rất có thể nghiên cứu và phân tích mặt hàng sinh hoạt chất hóa học được kĩ hơn:
https://langamthuctaynguyen.vn/cong-cu-hoa-hoc/day-hoat-dong-kim-loai
3. Bảng tính tan hóa học
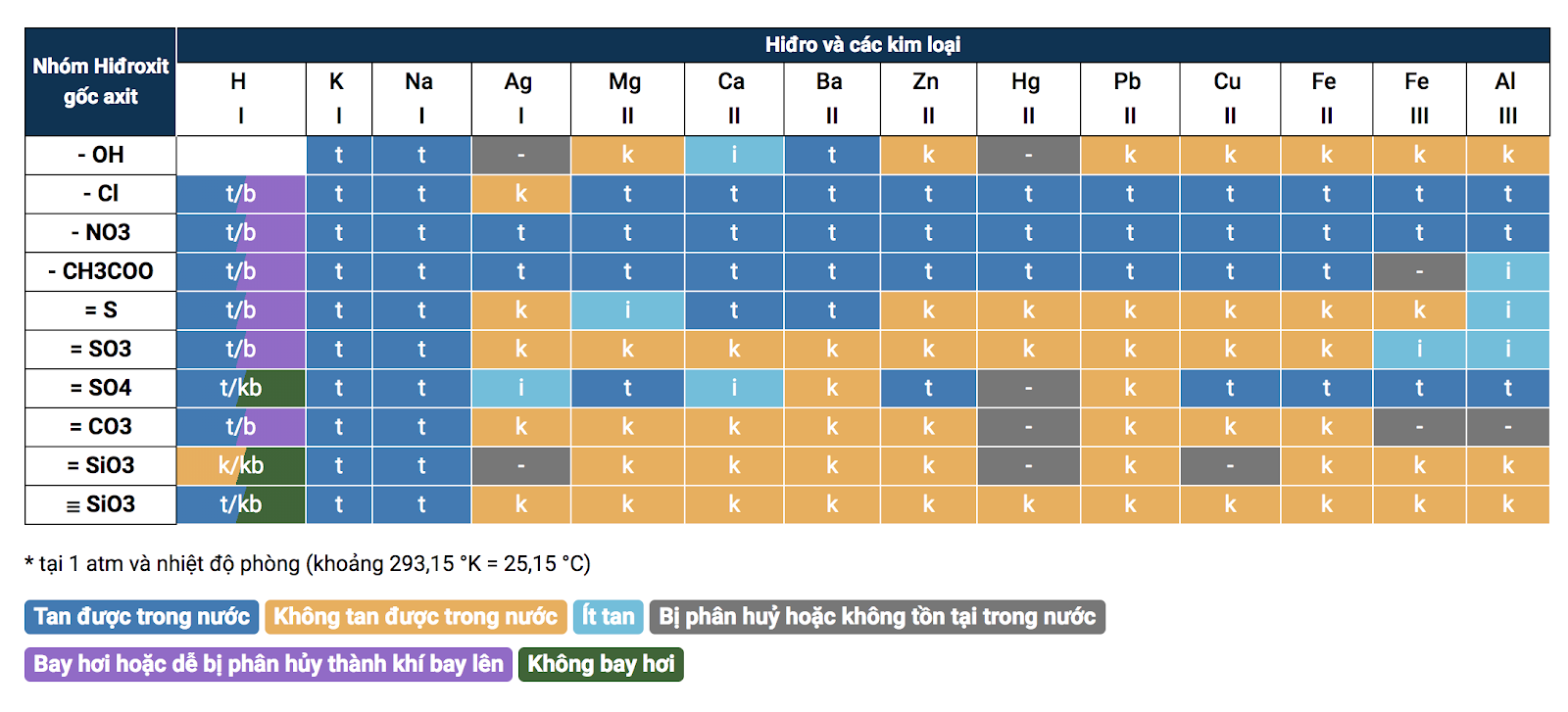
Bảng tính tan hóa học
Bảng tính tan được dùng để làm nhận thấy một hóa học sở hữu tan được nội địa hay là không (tan nhiều, tan không nhiều, hay là không tan).
Đây là 1 dụng cụ hữu ích nhằm những em học viên lấy địa thế căn cứ thực hiện những bài bác tập dượt dạng phân biệt những hóa học.
Để coi Bảng tính tan cụ thể rộng lớn, chúng ta hãy Click Tại đây!
4. Dãy năng lượng điện hóa của kim loại

Dãy năng lượng điện hóa của kim loại
(Xem không thiếu thốn mặt hàng năng lượng điện hóa)
Dãy năng lượng điện hóa của sắt kẽm kim loại tiếp tục mang lại tao biết những hóa học này thuộc tính được cùng nhau phụ thuộc quy tắc Alpha.
Kim loại đứng trước sở hữu tính khử mạnh rộng lớn sắt kẽm kim loại đứng sau
Kim loại đứng sau sẽ có được tính lão hóa mạnh rộng lớn sắt kẽm kim loại đứng trước.
III. Những cảnh báo vô công tác Hóa học
1. Hóa học tập 8
Tại nước Việt Nam, cỗ môn Hóa học tập được mang lại vô công tác giảng dạy dỗ chính thức kể từ lớp 8. Các em tiếp tục chính thức được tạo quen thuộc, được ra mắt thế này là chất? Thế này là nguyên vẹn tử? Thế này là nhân tố, hóa trị,.... Tại lớp này, những em học viên nên rất là cảnh báo tiếp thu kiến thức, nhằm rất có thể nắm vững những kỹ năng cơ phiên bản về cỗ môn này, rời biểu hiện Mất gốc Hóa, làm cho trở ngại mang lại việc cách tân và phát triển của những em ở những lớp tiếp theo sau.

Phương trình chất hóa học 8
Muốn coi những phương trình chất hóa học được xuất hiện nay vô công tác Hóa học tập 8, những em coi thêm thắt bên trên đây:
Tổng thích hợp những Phương trình chất hóa học lớp 8 không thiếu thốn nhất!
(Xem thêm thắt Giải bài bác tập dượt Hóa học tập 8)
2. Hóa học tập 9
Sau thời hạn thích nghi với cỗ môn Hóa lớp 8, những em đã và đang sở hữu một lượng kỹ năng về Hóa chắc chắn. Sang cho tới công tác lớp 9, những em sẽ tiến hành tiếp cận kỹ năng về những hóa học cơ học (bao bao gồm những hidrocacbon và dẫn xuất của hidrocacbon). Hình như, những em sẽ tiến hành nâng lên kỹ năng về thích hợp hóa học vô sinh (Oxit, axit, bazo và muối), học tập những định nghĩa về hóa học mới nhất (kim loại, phi kim,...) Đây tiếp tục là 1 năm học tập với những kỹ năng nặng trĩu rộng lớn năm cũ. Các em hãy nỗ lực chuyên nghiệp tâm nhằm ko bỏ lỡ bất kì kỹ năng Hóa học tập 9 hữu ích này nhé!
Xem không thiếu thốn những Phương trình Hóa học tập lớp 9
Chi tiết Giải bài bác tập dượt Hóa học tập 9
3. Hóa học tập 10
Tại công tác Hóa học tập 10, những em sẽ tiến hành biết kết cấu của một nguyên vẹn tử, thế này là nhân tố chất hóa học, thích nghi với bảng tuần trả chất hóa học và phương pháp bố trí những nhân tố vô bảng tuần trả, vận tốc phản xạ, cơ hội thăng bằng phương trình chất hóa học,...Hãy nằm trong để tâm nhằm hấp thụ không còn lượng kỹ năng xịn của Hóa học tập 10 nhé!
Để hùn những em rất có thể đơn giản và dễ dàng hoàn thiện công tác chất hóa học 10, Cunghocvui tiếp tục thuế tầm, tổ hợp lại những Phương trình chất hóa học lớp 10 không thiếu thốn nhất, Mời những em nằm trong coi bên trên Link: Tổng thích hợp Phương trình Hóa học tập 10
(Xem thêm thắt cụ thể Giải bài bác tập dượt Hóa học tập 10)
4. Hóa học tập 11
Chương trình Hóa học tập 11 tiếp tục fake những em tiếp cận với những kỹ năng về Sự năng lượng điện ly, dò thám hiểu những phi kim nằm trong group Nito, Cacbon,... và chính thức được học tập những hóa học cơ học.

Phương trình chất hóa học 11
Xem thêm: Tổng thích hợp Các phương trình Hóa học tập 11 không thiếu thốn nhất
Giải bài bác Tập Hóa học tập 11 chi tiết
5. Hóa học tập 12
Ở lớp 12, Các em sẽ tiến hành học tập về những thích hợp hóa học hữu cơ: Este - Lipit, cacbonhidrat, amin, amino axit, polime và những vật tư polime. Hình như, những em sẽ tiến hành học tập những kỹ năng mới nhất về Hóa vô sinh, đôi khi ôn tập dượt lại những kỹ năng Hóa kể từ những lớp bên dưới nhằm sẵn sàng mang lại kì đua chất lượng tốt nghiệp trung học phổ thông ngay cạnh. Hãy nỗ lực chịu khó dành riêng thời hạn mang lại cỗ môn này những em nhé!
Để rất có thể học tập gần giống ôn luyện được chất lượng tốt rộng lớn, hãy Click vô Link sau: Phương trình Hóa học tập 12 - Nơi tổ hợp những phương trình chất hóa học hoặc được dùng nhất vô công tác Lớp 12.
(Xem thêm thắt cụ thể Giải bài bác tập dượt Hóa học tập 11)
Xem thêm: Hợp âm Ai đưa em về - Nguyễn Ánh 9
IV. Những Công thức Hóa học tập cần thiết ghi nhớ
Hóa học tập tưởng khó khăn tuy nhiên thực ra là rất đơn giản, nếu khách hàng tiếp tục hiểu thực chất của những yếu tố vô Hóa học tập. Hãy nỗ lực nằm trong ở lòng những công thức Hóa học tập, nhằm mỗi lúc cần thiết, chúng ta chỉ việc lôi đi ra và vận dụng. Nếu thực hiện được điều này, thì Hóa tiếp tục không có gì là tương đối khó tí này nữa. Để giúp đỡ bạn, Shop chúng tôi đã từng đi thuế tầm và tổ hợp lại được những Công thức Hóa học tập cần thiết và hoặc được dùng nhất. Rất ao ước nó sẽ bị là cuốn bong tay học tập chất lượng tốt giúp đỡ bạn vượt qua từng bài bác Hóa khó khăn.
Click ngay lập tức nhằm coi Tổng thích hợp Công thức Hóa học tập của Cunghocvui.
Phương trình hóa học của Chúng tôi vô cùng kiêu hãnh khi được nằm trong các bạn tò mò toàn cầu học thức. Cảm ơn chúng ta tiếp tục quan hoài và theo đuổi dõi!










Bình luận